例析多池相連電化學裝置的解題方法
時間:2019年03月13日 分類:教育論文 次數(shù):
【摘要】電化學模塊是高中化學基本理論體系中的重要內(nèi)容,是教學中的重點與難點,文章就多池相連問題中常見題型展開討論,尋找解題方法,幫助學生建立思維模型,培養(yǎng)學生邏輯思維能力。
【關鍵詞】多池相連,電化學,解題方法
1引言
電化學知識是近幾年全國各省市高考題中的必考考點,它是基于氧化還原反應、化學反應中的能量變化等知識的深度學習,電化學分為原電池與電解池兩大模塊,但考題中通常不單獨考察,而是多池相連綜合考察,因而要求學生具有扎實的基礎知識儲備與強大的邏輯思維體系。因此本文舉例分析常見的多池相連問題的題型特點和相應的解題方法談談自己的見解。
2無外接電源型
2.1建立認知角度
此類題型關鍵是確定原電池,判斷方法主要有:找裝置中最活潑金屬,其在裝置為原電池(即能自發(fā)進行氧化還原反應的電池),其余為電解池;在電極附近有可燃物通入的裝置是原電池,其余為電解池。
2.2建立角度關聯(lián)
根據(jù)原電池的形成條件確定其正負極,較活潑金屬或可燃物做負極,另一極為正極。與原電池負極相連的是電解池的陰極,與正極相連的是陽極,串聯(lián)電池中陰陽電極交替出現(xiàn)。
2.3建立思維模型
根據(jù)解題需要建立思維模型,正確書寫電極反應方程式,判斷電子轉(zhuǎn)移方向,陰陽離子移動方向等,緊抓相同時間內(nèi)電極通過電子的物質(zhì)的量相等這一橋梁來解答電化學中的定量計算。例:如圖裝置甲池的總電極反應式為2CH。OH+30+4KOH===2K2CO+6}{20。下列敘述正確的是()
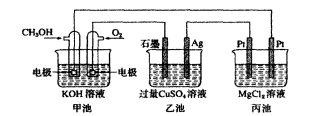
A.甲池是原電池,乙池是化學能轉(zhuǎn)化為電能的裝置B.乙池中,船電極的電極反應式為Ag—e—IAC.反應一段時間后,若要使CuS04溶液恢復到原濃度則向乙池中加入一定量cu(OH),固體D.當甲池中消耗標準狀況下28OraL0,,理論上丙池中最多產(chǎn)生固體1.45g解析:甲池中有CH。OH通入做原電池,乙池和丙池為電解池,能量是電能轉(zhuǎn)化為化學能,A錯。
甲池中負極為通入cH。0H的一極,正極為通入O的一極,乙池中Ag作陰極,電極反應為cu+2e一===Cu,B錯。恢復原溶液的原則是電解了什么則加入什么,乙池中;2CuSOd+2H20墨2Cu+2H2so4+02f,應加入CuO或CuCO3,C錯。丙池中:MgC12+2H20Mg(0H)2l+cl2f+H2f,當消耗標況下280mL02,0.0125mol時,轉(zhuǎn)移e-O.05mol,生成Mg(OH),0.025mol,質(zhì)量為1.45g。
3有外接電源型
(1)建立認知角度:針對有電源的此類題型,全部為電解池、電鍍池或精煉池等。
(2)建立角度關聯(lián):若已知電源的正負極,則與電源負極相連的是電解池的陰極,與正極相連的是陽極,根據(jù)串聯(lián)電池中電極交替出現(xiàn)原則順推其他電極;若未知電源的正負極,則需要根據(jù)某極發(fā)生的現(xiàn)象逆推電極(隱含著電子流向、陰陽離子移動方向等解題依據(jù))。
(3)建立思維模型:與無外接電源型類似例:如圖裝置
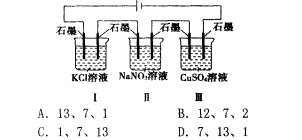
電解一一段時間,當某極析出0.32gCu時,I、II、III中溶液pH分別為(溶液足量,體積均為100mL且電解前后溶液體積變化忽略不計)()解析:I、II、III均為電解池,I中石墨(左)與電源正極相連為陽極,石墨(右)為陰極,II、III中依次交替。n(Cu)=0.O05mo1,由IⅡ中陰極的電極反應為Cu2++2e:==cu可知轉(zhuǎn)移eO.Olmo1,I、II、III中電解方程式分別為2KC1+2H2()2KOI-{+H2f+c1zf、2H20竺2H,f+02f、2CUSO4+2HeO~=2Cu+Ozf+2sQ。當轉(zhuǎn)移eO.Olmol時,則I中生成Of0.01mol,c(0K)=0.1mol/L,州=13;II電解水,溶液仍然呈中性,溶液的pH=7;III中生成0.Olmolf,c(}r)=0.1rnol/L,pH=l,故選A。
4雙控型
此類題型是前面兩類的綜合運用,通過電建的斷開與閉合,從而改變認知角度。例:有關下列裝置的敘述中正確的是()
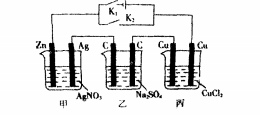
A.斷開K,閉合K2后,甲、乙池能將化學能轉(zhuǎn)化為電能B.斷開K,閉合K,后,丙池中C(c1)減小C.斷開,閉合K.后,乙池右邊c電極上的電極反應式為401-{4e一:==2H2O+02fD.斷開K。.閉合K后,一段時間后甲、乙、丙三池中的陽極均被腐蝕了解柝斷開K,閉合K2后,整個裝置中為無外接電源型,由于鋅銀銅中鋅為最活潑金屬,故甲池是原電池,則乙、丙兩池為電解池,乙池是將電能轉(zhuǎn)化為化學能,A錯。
甲池中Zn做負極,丙池中與zn相連的Cu(右)電極為陰極,Cu(左)電極為陽極,cu一2e一=Cu,金屬電極做陽極,參與電極反應,cl一不放電,B錯。斷開K。,閉合K后,三個池子均變成電解池,甲池中Zn與電源負極相連做陰極,則乙池中C(右)電極為陽極,40H-4e一:2H20+0,f,c正確;石墨是惰性電極,本身不參與電極反應,D錯。
解答電化學的相關題型,氧化還原反應是基礎,原電池與電解池的工作原理是關鍵,經(jīng)分析發(fā)現(xiàn),無論電化學以哪種題型出現(xiàn),基礎知識都是考察的重點和核心,這就要求學生在強化基礎知識的同時,不斷減少迷思概念,形成一定的邏輯思維體系,構建解題模型,當遇到綜合性較強的題型時就能迎刃而解了。
【參考文獻】
[1]李輝,徐丈華.電化學電極反應式書寫“三步曲”[J].高中數(shù)理化.2015(5):56—58.
化學教學論文范文:高中化學實驗中問題解決方式
學好數(shù)理化,走遍全天下,由此可見這三門課程的重要性,這也是高中理科中的主要學科,尤其是高中化學的學習,在高中化學學習中有一些實用性強與生活密切相關的知識點,這些知識點可以通過化學實驗課程內(nèi)容體現(xiàn)出來,實驗來源于生活,也引領著生活,根據(jù)生活講述其中的重要原理,從原理提升生活的實踐質(zhì)量。下面文章就總結高中化學學習中的實驗內(nèi)容,并提出自己的看法,希望可以對化學知識的學習有重要的幫助。
SCI期刊目錄
SCI論文
- 2025-01-254本工程類高性價比SCI期刊推薦:
- 2025-01-23自動化與控制系統(tǒng)4區(qū)期刊IMA J M
- 2025-01-23被SCI拒稿的文章從哪些方面修改
SSCI論文
- 2025-01-25通過率高!推薦6本超好發(fā)的藝術SS
- 2025-01-22語言專業(yè)研究生適合投的外文期刊
- 2024-12-24教育類ssci期刊大全,來自最新ss
EI論文
- 2025-01-24如何提升ei論文水平
- 2024-12-282024.11版EI期刊目錄,新增18本
- 2024-12-262025年即將舉辦的醫(yī)學國際會議
SCOPUS
- 2025-01-24scopus發(fā)表文章格式修改指南
- 2024-11-19Scopus收錄的建筑工程類期刊
- 2024-05-29scopus收錄哪些管理類期刊
翻譯潤色
- 2024-11-22國際中文期刊發(fā)表論文應該用什么
- 2024-11-22國際中文教師能在國際中文期刊發(fā)
- 2024-11-22國際中文期刊評職稱承認嗎
期刊知識
- 2025-01-24期刊單核、雙核是什么意思
- 2025-01-23城市交通發(fā)展相關文章適合投的期
- 2025-01-21天文天體學外文期刊合集
發(fā)表指導
- 2025-01-25論文投稿前要檢查哪些內(nèi)容?
- 2025-01-24醫(yī)學研究生的畢業(yè)論文選題講解
- 2025-01-23民俗文化方向的論文文獻39篇